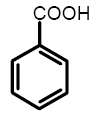
Бензойная кислота
Группа веществ:
Консерванты
Молекулярная масса 122,05; бесцветные кристаллы; t плавления 122,4 °C, t кипения 249,2 °C, 133°С/10 мм рт. ст., t возгонки 100 °C; плотность 1,316 г/см3 при 25 °C; η 1,67мПа·с (122,5 °C), 1,26 мПа·с (130 °C); Растворимость при 25 °C (г в 100 г растворителя): в воде – 0,34 (1,77 при 70 °C; Nа-соли – 61,2); абсолютном этаноле – 58,4; эфире – 40,8; бензоле – 12,2. Бензойная кислота обладает всеми химическими свойствами монокарбоновых кислот. При 370°С она разлагается до бензола и СО2 (в небольшом количестве образуются фенол и СО); процесс ускоряется в присутствии порошкообразных Сu или Со. При взаимодействии с бензоилхлоридом при повышенных температурах Бензойная кислота превращается в бензойный ангидрид (С6Н5СО)2О – кристаллы; t плавления 42°С, t кипения 360°С; растворимоять в воде 0,01 г/л; устойчив в воде и холодных растворах щелочей.
Бензойная кислота и ее эфиры содержатся в эфирных маслах (например, в гвоздичном), толуанском и перуанском бальзамах, бензойной смоле. Производная бензойной кислоты и глицина – гиппуровая кислота C6H5CONHCH2COOH – продукт жизнедеятельности животных.
Основной промышленный способ получения бензойной кислоты – жидкофазное окисление толуола воздухом при 130-160°С и давлении 308-790 кПа (катализатор – бензоаты Со и Mn, промотированные соединениями Вг); выход близок к теоретическому. Бензойная кислота может быть получена также гидролизом бензотрихлорида С6Н5ССl3 или бензонитрила.
Бензойная кислота и ее соли обладают высокой бактерицидной и бактериостатической активностью, резко возрастающей с уменьшением рН среды. Благодаря этим свойствам, а также нетоксичности бензойную кислоту применяют как консервант в пищевой промышленности (добавка 0,1% кислоты к соусам, рассолам, фруктовым сокам, джемам, мясному фаршу и др.), антисептик в медицине (главным образом в дерматологии), парфюмерии и косметике. Бензойную кислоту используют в производстве фенола, капролактама, бензоилхлорида, как добавку к алкидным лакам, улучшающую блеск, адгезию, твердость и химическую стойкость покрытия.
Большое практическое значение имеют соли и эфиры бензойной кислоты (бензоаты). Бензоат натрия – консервант пищевых продуктов, стабилизатор полимеров, ингибитор коррозии в теплообменниках, отхаркивающее средство в медицине. Бензоат аммония (t возгонки 160°С, t разложения 198 °С) – антисептик, консервант в пищевой промышленности, ингибитор коррозии, стабилизатор в производстве латексов и клеев. Бензоаты переходных металлов – катализаторы жидкофазного окисления алкилароматических углеводородов в бензойную кислоту. Сложные эфиры бензойной кислоты от метилового до изоамилового – душистые вещества. Метил- и этилбензоаты входят в состав эфирных масел – иланг-илангового, туберозы, гвоздики. Метилбензоат – растворитель эфиров целлюлозы. Изоамилбензоат – компонент фруктовых эссенций. Бензилбензоат – фиксатор запаха в парфюмерии, растворитель душистых веществ, антисептик, репеллент от моли.
Для бензойной кислоты t воспламенения 121-131 °С. Раздражает кожу; вдыхание аэрозоля вызывает судорожный кашель, насморк, иногда тошноту и рвоту. Получение бензойной кислоты при сухой перегонке бензойной смолы было описано еще в середине XVI в.; в 1832 г. Ф.Вёлер и Ю.Либих установили ее структуру.
Хроматограммы образцов, содержащих это вещество
| Название | Колонка | Детектор |
|---|---|---|
| Стандартная смесь добавок к безалкогольным напиткам | Luna C18(2) 250х4.6 мм 5 мкм | Спектрофотометрический |
| «Амброксол» | Synergi Max-RP 250х4.6 мм 4 мкм | Спектрофотометрический |